Aquaporin
Aquaporiner er selektive membranproteiner, der danner porer i cellemembranen, som tillader passage af vand ind og ud af cellen og samtidig hindrer passage af ioner og andre opløste molekyler. Derfor kaldes aquaporiner også vand-kanaler. Passagen af vand gennem aquaporiner er en passiv proces.

Hos mennesket er der påvist 11 forskellige aquaporiner, hos planter mindst 35.[1]
Nogle nært beslægtede molekyler, kendt som aquaglyceroporins, er dog knap så specifikke, men tillader små molekyler at passere: glycerin, kuldioxid, ammoniak og urinstof på tværs af membranen, afhængigt af størrelsen af poren. Andre membranproteiner, der grupperes som poriner har en anden struktur som beta-barrel.
Peter Agre fra Johns Hopkins University fik i 2003 Nobelprisen for opdagelsen og beskrivelsen af vand-kanalerne.[2]
Struktur
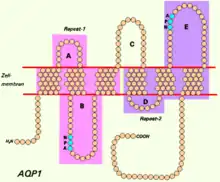
Det funktionelle aquaporin er opbygget af fire ens monomerer med hver deres pore for vandpassage. En aquaporin monomer udgøres af seks transmembrane α-helixer med en aminoterminal og en carboxylterminal på den cytoplasmatiske side af membranen (se den skematiske model).